 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
RESOLUCIÓN 1703 DE 2022
(septiembre 15)
Diario Oficial No. 52.158 de 15 de septiembre de 2022
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<NOTA DE VIGENCIA: Resolución derogada por el artículo 3 de la Resolución 986 de 2023>
Por la cual se modifica la Resolución 1140 de 2022, en relación con la aplicación del segundo refuerzo de vacuna contra la Covid-19 en población entre 18 y 49 años, la vigilancia de eventos adversos posteriores a la vacunación, la ampliación del rango de edad para el uso de la vacuna SPIKEVAX Covid-19 VACCINE MODERNA en menores de 6 a 11 años y el desarrollo de espacios de coordinación al interior de las entidades territoriales.
LA MINISTRA DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades, especialmente de las conferidas por el literal b) del artículo 488 de la Ley 9 de 1979, los numerales 3 del artículo 173 de la Ley 100 de 1993, 42.1 del artículo 42 de la Ley 715 de 2001, 3, 4 y 9 del artículo 2o del Decreto ley 4107 de 2011, 19.1 del artículo 19 del Decreto 109 de 2021, y
CONSIDERANDO:
Que el Gobierno nacional mediante el Decreto 109 de 2021 modificado por los Decretos 404, 466, 630, 744, 1671 de 2021 y 416 de 2022 estableció como objetivos del Plan Nacional de Vacunación contra el Covid-19 la reducción de la morbilidad grave y la mortalidad específica por Covid-19, disminuir la incidencia de casos graves, proteger a la población con alta exposición al virus y aportar a la reducción de la transmisión del SARS-CoV-2 en la población general con el propósito de contribuir al control de la epidemia en el país.
Que mediante la Resolución 1140 de 2022 se adoptaron los nuevos lineamientos para la aplicación de las vacunas contra la Covid-19.
Que el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) mediante la Resolución 2022019162 del 24 de junio de 2022, concedió la renovación automática de la Autorización Sanitaria de Uso de Emergencia (ASUE), por una (1) sola vez, por el término de un (1) año, al producto SPIKEVAX Covid-19 VACCINE MODERNA, en la cual se incluye la indicación de uso para la población mayor a 6 años.
Que en sesión del 24 de agosto de 2022 el Comité Asesor para el Proceso Estratégico de Inmunización de la Población Colombiana frente a la Covid-19, analizó y recomendó la aplicación de un segundo refuerzo de la vacuna contra Covid-19 a la población de 18 a 49 años sin que para ello sea necesario una recomendación médica.
Que, adicionalmente, se requiere especificar que el Instituto Nacional de Salud (INS), es el responsable de consolidar los casos de Eventos Adversos Posteriores a la Vacunación (EAPV) graves y la información en Vigiflow e informar esos casos al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima).
Que, el artículo 20 del Decreto 109 de 2021, refiere las responsabilidades de las entidades territoriales departamentales y distritales y en sus numerales 20.5 establece que deben gestionar las acciones intersectoriales para la articulación de estrategias que permitan el cumplimiento de los objetivos del Plan Nacional de Vacunación contra el Covid-19 y en el 20.6 dispone que les corresponde definir las estrategias y tácticas de vacunación y el proceso de microplanificación para el logro de la meta establecida a los municipios, localidades o áreas de su jurisdicción.
Que, se hace necesario que las entidades territoriales a través de sus equipos de vigilancia en salud pública, los prestadores de servicios de salud y las entidades responsables del aseguramiento cuenten con un espacio de coordinación en el que se realice la conciliación de las estrategias a emplear en el Plan Nacional de Vacunación y el seguimiento al registro adecuado de las vacunas aplicadas.
Que, en desarrollo de tales espacios y en el marco de la estrategia de apertura y cierre de los puntos de vacunación asociados a las sedes de los prestadores, se dispondrá un instrumento en el que se diligencia dicha información.
Que en consideración a lo expuesto se hace necesario modificar los numerales 2.1,2.4, 6.1, 6.2.2., 8.1 y 14.1 del Anexo Técnico 1 de la Resolución 1140 de 2022 y sustituir sus Anexos Técnicos 2 y 7.
En mérito de lo expuesto,
RESUELVE:
ARTÍCULO 1o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Modificar los numerales 2.1 “Entidades territoriales departamentales y distritales” y 2.4 “Prestadores de servicios de salud” del numeral 2 del Anexo Técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1140 de 2022, en los siguientes términos:
“2. Responsabilidad de los actores
Los actores que tienen a cargo el desarrollo de las actividades de vacunación contra la Covid-19 deberán:
2.1 Entidades territoriales departamentales y distritales
2.1.1. Adoptar y adaptar los lineamientos técnicos y operativos de la vacunación contra la Covid-19.
2.1.2. Verificar el cumplimiento a lo establecido en la Resolución 3100 de 2019 por parte de las IPS de su territorio, así como de la suficiencia del talento humano para garantizar la vacunación con oportunidad contra la Covid-19.
2.1.3. Contar con personal para la gestión y operación de la vacunación contra la Covid-19.
2.1.4. Participar en las reuniones de actualización y seguimiento de acuerdo con la convocatoria por parte de este Ministerio.
2.1.5. Apoyar, con su equipo de vigilancia en salud pública y a través espacios de coordinación, las actividades de vacunación contra la Covid-19, con la participación de los prestadores de servicios de salud y las entidades Responsables del aseguramiento que operen en el territorio.
2.1.6. Efectuar el seguimiento a las actividades que realicen los responsables del aseguramiento y los prestadores de servicios de salud para la vacunación contra la Covid-19 en el territorio.
2.1.7. Brindar asistencia técnica a los municipios y demás entidades responsables de la vacunación en la planeación, ejecución, seguimiento y evaluación de la vacunación en su territorio incluyendo la realizada contra la Covid-19.
2.1.8. Coordinar con instituciones responsables de la vacunación en el territorio, así como con actores aliados y demás entidades que desarrollan políticas públicas, la difusión y divulgación de la vacunación como una medida más costo efectiva para la prevención de enfermedades, incluyendo la vacuna contra la Covid-19.
2.1.9. Fortalecer los equipos de farmacovigilancia.
2.1.10. Verificar que se realice la notificación oportuna del error programático en el aplicativo VigiFlow, informar el caso al Ministerio de Salud y Protección Social, participar en las mesas técnicas que se programen, realizar seguimiento a los compromisos establecidos en las actas de mesa técnica en sus municipios e instituciones prestadoras de servicios de salud, donde se evidencien las acciones derivadas de los planes de mejora en las Instituciones vacunadoras, así como fortalecer las estrategias de capacitación y adherencia a los lineamientos del Plan Nacional de Vacunación contra la Covid-19 en su territorio, para evitar errores o eventos adversos.
2.1.11. Notificar al Ministerio de Salud y Protección Salud en la herramienta Excel de error programático y fortalecer las acciones de seguimiento, así como de fortalecimiento de capacidades descritas en el Manual Técnico y Operativo del PAI, en su capítulo 6 titulado Vacunación Segura.
2.1.12. Realizar solicitud de biológicos e insumos para la vacunación contra Covid-19 al Ministerio de Salud y Protección Social de manera periódica, garantizando un stock suficiente para cubrir las necesidades de sus instituciones prestadoras de servicios de salud y municipios.
2.1.13. Distribuir oportunamente las vacunas, diluyentes, jeringas, carné y otros insumos al interior de su territorio.
2.1.14. Realizar el seguimiento al movimiento de insumos y biológicos.
2.1.15. Amparar las vacunas e insumos para la vacunación, mediante póliza de seguro con cobertura todo riesgo, mientras estos estén bajo su custodia.
2.1.16. Consolidar de forma semanal los reportes del avance de la vacunación contra la Covid-19 según lo defina este Ministerio, con criterios de calidad de la información reportada.
2.1.17. Monitorear y evaluar los resultados del avance de la vacunación contra la Covid-19 y priorizar intervenciones tendientes a mejorar las coberturas en su territorio.
2.1.18. Garantizar la correcta custodia y almacenamiento de los biológicos e insumos.
2.1.19. Garantizar la cadena de frío según los requerimientos del fabricante y lo establecido por el Ministerio de Salud y Protección Social.
2.1.20. Garantizar el monitoreo permanente de las condiciones de almacenamiento y de transporte con instrumentos debidamente calibrados de las vacunas bajo su custodia.
2.1.21. Contar con una planta eléctrica con transferencia automática y garantizar el combustible para su funcionamiento.
2.1.22. Realizar seguimiento para el correcto uso de los bienes e insumos que sean entregados por el Gobierno nacional.
(…)
2.4 Prestadores de servicios de salud
2.4.1. Realizar el cálculo de necesidades de talento humano, vacuna e insumos de la vacunación contra la Covid-19 según la meta.
2.4.2. Garantizar la contratación de los equipos vacunadores de acuerdo con la población asignada.
2.4.3. Capacitar y actualizar permanentemente al talento humano en salud encargado de la vacunación contra la Covid-19.
2.4.4. Realizar seguimiento a la aplicación del esquema completo de la vacuna contra la Covid-19.
2.4.5. Desarrollar las estrategias y tácticas de vacunación acordadas con las entidades responsables del aseguramiento que tienen a cargo actividades dentro del Plan Nacional de Vacunación y entidades territoriales, teniendo en cuenta el enfoque diferencial para grupos vulnerables y grupos étnicos y registrar en SISPRO el anexo denominado “Formulario para la actualización de los puntos de vacunación por sede de prestador”.
2.4.6. Almacenar y custodiar los biológicos cumpliendo las normas de cadena de frío.
2.4.7. Amparar mediante póliza de seguro todo riesgo las vacunas e insumos para la vacunación contra la Covid-19, mientras estos estén bajo su custodia.
2.4.8. Contar con la disponibilidad suficiente de los insumos requeridos para el proceso de vacunación contra la Covid-19.
2.4.9. Distribuir el biológico a sus vacunadores según meta día, de acuerdo con las normas de cadena de frío.
2.4.10. Garantizar los elementos de protección personal para el equipo de vacunación y de red de frío.
2.4.11. Garantizar la correcta custodia y almacenamiento de los biológicos e insumos.
2.4.12. Garantizar el monitoreo permanente de las condiciones de almacenamiento y de transporte con instrumentos debidamente calibrados de las vacunas bajo su custodia.
2.4.13. Contar con una planta eléctrica con transferencia automática y garantizar el combustible para su funcionamiento.
2.4.14. Elaborar, socializar y garantizar el protocolo y ruta de atención, al servicio de urgencias para los usuarios que así lo requieran.
2.4.15. Garantizar técnica y financieramente el funcionamiento del sistema de información, en cada uno de los niveles conforme a las responsabilidades establecidas por este Ministerio.
2.4.16. Cargar la información al aplicativo PAIWEB y consolidar la información en los formatos diseñados para la vacunación contra la Covid-19. De no ser posible realizarlo en su institución, deberá hacer las gestiones pertinentes para que la información sea cargada al aplicativo PAIWEB desde otro punto que cuente con la conectividad requerida para dicho proceso y que esta se mantenga actualizada.
2.4.17. Consolidar el informe de avance de las personas vacunadas contra la Covid-19 y enviarlo al nivel superior de forma semanal
2.4.18. Garantizar la confidencialidad de la información de los usuarios vacunados.
2.4.19. Garantizar que su red prestadora de servicios de cumplimiento a la Circular No 044 del 19 de noviembre de 2013 expedida por este Ministerio.
2.4.20. Dar cumplimiento al Plan de Gestión Integral de Residuos Hospitalarios frente al manejo de los residuos que genere el procedimiento de vacunación y actualizarlo de acuerdo con los sitios de expansión y a los residuos generados por la red de frío.
2.4.21. Realizar la facturación y envío de soportes definidos para el pago del servicio.
2.4.22. Garantizar el mantenimiento correctivo y preventivo de los equipos de red de frío.
2.4.23. Notificar al MSPS en la herramienta Excel de error programático y fortalecer las acciones de seguimiento, así como de fortalecimiento de capacidades descritas en el Manual Técnico y Operativo del PAI, en su capítulo 6 titulado Vacunación Segura.
2.4.24. Verificar que se realice la notificación oportuna del error programático en el aplicativo VigiFlow, informar el caso al departamento o distrito.
2.4.25. Realizar mesas técnicas interinstitucional con las áreas de seguridad del paciente, oficina de calidad, gestión del riesgo, talento humano, farmacovigilancia, epidemiología y PAI, la cual como resultado debe generar un acta, plan de mejora y seguimiento al usuario.
2.4.26. Realizar seguimiento a los compromisos establecidos en las actas que soportan el proceso, donde se evidencien las acciones derivadas de los planes de mejora en las Instituciones.
2.4.27. Detectar y notificar los Eventos Adversos Posteriores a la Vacunación graves y garantizar la atención integral en salud.
2.4.28. Implementar las acciones de información en salud y educación y comunicación para la salud acerca de la vacunación contra la COVID-19, cumpliendo medidas de accesibilidad y adaptabilidad, conforme a los lineamientos de este Ministerio.
2.4.29. Garantizar los apoyos y ajustes razonables para que las personas accedan según el enfoque diferencial a la vacunación sin barreras físicas, comunicacionales y actitudinales.
2.4.30. Brindar información al usuario relacionada con la vacuna, beneficios, riesgo, indicaciones, contraindicaciones, posibles eventos adversos, así como verificar si la persona comprendió la información suministrada.
2.4.31. Informar a los usuarios que la vacunación es voluntaria y diligenciar el consentimiento informado, así como salvaguardarlo.
2.4.32. Cumplir con los requisitos definidos, tanto en la modalidad intramural como en la extramural”.
ARTÍCULO 2o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Modificar el numeral 6.1 “Esquema primario” del Anexo Técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1140 de 2022, en los siguientes términos:
“6.1 Esquema primario
El esquema primario está constituido por la aplicación de dos dosis o vacunas de dosis única a la población según el siguiente esquema:
Tabla 1. Esquema y biológico recomendado para vacunación contra la Covid-19
| Edad recomendada de aplicación | Biológico recomendado |
| 3 a 5 años | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| 6 a 11 años | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| Moderna ARNm-1273, Switzerland GmbH* | |
| 12 a 17 años | Pfizer Inc y BioNTech |
| Moderna ARNm-1273, Switzerland GmbH | |
| Sinovac Life Scienses Co Ltd denominada CoronaVac | |
| 18 años y más | Sinovac Life Scienses Co Ltd denominada CoronaVac |
| Pfizer Inc y BioNTech | |
| Moderna ARNm-1273, Switzerland GmbH | |
| ChAdOx1-S* recombinante o AZD1222 del laboratorio AstraZeneca | |
| Janssen Pharmaceutica NV | |
* La administración de vacuna Moderna ARNm-1273, Switzerland GmbH, en niños de 6 a 11 años se realizará en una serie de 2 (dos) dosis de 50 microgramos (0,25 ml cada una) con un intervalo de 28 días después de la primera dosis”.
ARTÍCULO 3o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Modificar el numeral 6.2.2. “Segundo refuerzo” del Anexo Técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1140 de 2022, en los siguientes términos:
“6.2.2. Segundo refuerzo
Las personas mayores de 18 años podrán recibir una segunda dosis de refuerzo de vacuna contra la Covid-19, la cual deberá ser aplicada a partir del cuarto mes posterior a la aplicación del primer refuerzo.
Las vacunas que deberán ser usadas para este segundo refuerzo son las de plataforma ARN mensajero (Pfizer o Moderna). Cuando el segundo refuerzo se realice con vacuna del laboratorio Moderna, se deberá usar la mitad de la dosis, equivalente a 50 microgramos (0.25 ml); sin embargo, podrán recibir la dosis de otro biológico si el médico así lo recomienda, siempre y cuando esté disponible y autorizado en el país”.
ARTÍCULO 4o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Modificar el numeral 8.1 Estrategias de vacunación del Anexo Técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1140 de 2022, en los siguientes términos:
“8.1 Estrategias de Vacunación
Dando cumplimiento a lo establecido en la Resolución 3100 de 2019, la vacunación se realiza a través de las modalidades intramural o extramural como parte de las acciones de salud pública para lograr la protección de la población y según los estándares establecidos para la prestación del servicio. En la medida en que progresivamente se da cumplimiento a la vacunación en la población sujeto, se deben ir evaluando los avances y las tácticas establecidas e ir incorporando nuevas cuando las anteriores ya disminuyan su productividad, incluso el operar varias tácticas al tiempo puede agilizar los procesos de vacunación, siempre y cuando se realice evaluación periódica de las mismas.
La estrategia de vacunación se define entre los prestadores de servicios de salud y las entidades promotoras de salud, las entidades adaptadas, los administradores de los regímenes Especial y de Excepción en salud, el Fondo Nacional de Salud de las personas privadas de la libertad y los departamentos y distritos en los espacios de coordinación territorial, debiendo diligenciar el prestador de servicios de salud el “Formulario para la actualización de los puntos de vacunación por sede de prestador” en la Plataforma SISPRO y la entidad territorial un acta o registro de control del desarrollo de dichas mesas.
ARTÍCULO 5o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Modificar el numeral 14.1 “Vigilancia de eventos adversos posteriores a la vacunación Eventos Adversos Posteriores a la Vacunación” del Anexo técnico 1 “Lineamientos técnicos y operativos para la vacunación contra el Covid-19” de la Resolución 1140 de 2022, en los siguientes términos:
“14.1 Vigilancia de eventos adversos posteriores a la vacunación EAPV
La vigilancia de los Eventos Adversos Posteriores a la Vacunación – EAPV contribuye a la detección temprana y clasificación adecuada de los casos producidos por vacunas Covid-19; de acuerdo con el Decreto 601 del 2021 “Por el cual se desarrollan las competencias frente a la vigilancia de los eventos adversos posteriores a la vacunación contra el Covid – 19 y se reglamenta el artículo 4o de la Ley 2064 de 2020”.
ARTÍCULO 6o. <Resolución derogada por el artículo 3 de la Resolución 986 de 2023> Sustituir el Anexo Técnico 2 “Consentimiento informado para la aplicación de la vacuna contra el SARS-COV-2/ Covid-19” y el Anexo Técnico 7 “Anexo técnico para la aplicación de la vacuna Moderna Rnam-1273 contra la Covid-19” de la Resolución 1140 de 2022.
ARTÍCULO 7o. La presente resolución rige a partir de la fecha de su publicación y modifica el Anexo Técnico 1 y sustituye los Anexos Técnicos 2 y 7 de la Resolución 1140 de 2022.
Publíquese y cúmplase.
Dada en Bogotá, D.C., a 15 de septiembre de 2022
La Ministra de Salud y Protección Social,
Diana Carolina Corcho Mejía.
CONSENTIMIENTO INFORMADO PARA LA APLICACIÓN DE LA VACUNA CONTRA EL SARS-CoV-2/ COVID-19
CIUDAD_________________FECHA: DÍA______MES______ AÑO________ HORA: ___________
DATOS DE IDENTIFICACIÓN DE LA PERSONA
NOMBRES___________________________________APELLIDOS____________________________________
TIPO DE IDENTIFICACIÓN:RC__TI__CC__CE__OTRO___NÚMERO ____________________
FECHA DE NACIMIENTO DÍA____MES____AÑO______ EDAD______ AÑOS
NOMBRE DE LA EAPB RESPONSABLE _____________________________ __________________________
MUJER EN ESTADO DE EMBARAZO SÍ______ NO APLICA _____
INFORMACIÓN PREVIA. La vacunación es una forma segura y eficaz de prevenir enfermedades y salvar muchas vidas. En la actualidad el país dispone de vacunas para proteger contra al menos 26 enfermedades, entre ellas, la difteria, el tétanos, la tos ferina, la poliomielitis, la hepatitis, el cáncer de útero y el sarampión. Con la aplicación de las vacunas las personas se protegen a sí mismas y a quienes las rodean. La vacunación contra el SARS- CoV-2/COVID-19 reducirá la posibilidad de presentar la enfermedad. Con su aplicación se han reconocido beneficios y riesgos, que es importante que usted conozca antes de dar el consentimiento para su aplicación. Esta vacuna tiene Aprobación de Uso de Emergencia y surtió los pasos para la validación científica y sanitaria que permite su aplicación segura en humanos.
DATOS IMPORTANTES DE LA VACUNA (por favor, leer con detenimiento. Puede formular preguntas)
| ¿CÓMO SE APLICA? | Administración vía intramuscular en el brazo (tercio medio del músculo deltoides). |
| VACUNA Y DOSIS | Nombre de la vacuna a aplicar___________________________ Primera dosis_____ segunda dosis_____ dosis única_____ |
| BENEFICIOS | Prevención de la enfermedad COVID-19, causada por el virus SARS-CoV-2. Reducción de la severidad de la enfermedad en caso de presentarse. Potencial protección del entorno familiar y los allegados. |
| RIESGOS | Presentación de efectos adversos a corto y mediano plazo posterior a su aplicación como: dolor en el sitio de inyección, dolor de cabeza (cefalea, articulaciones (artralgia), muscular (mialgia); fatiga (cansancio); resfriado; fiebre (pirexias); enrojecimiento e inflamación leve en el lugar de la inyección; inflamación de los ganglios (linfadenopatía); malestar general; sensación de adormecimiento en las extremidades, reacciones alérgicas leves, moderadas o severas. Estos no se presentan en todas las personas. |
| ALTERNATIVAS | A la fecha no se ha identificado otra medida farmacológica más eficaz que la vacunación para la prevención de la COVID-19. |
INFORMACIÓN ESPECÍFICA PARA GESTANTES
Esta tiene aprobado el uso en mujeres gestantes desde la semana doce (12) y durante los 40 días postparto, siempre que los posibles beneficios superen los posibles riesgos con base en la evaluación clínica realizada en conjunto por el médico tratante y la gestante.
La vacuna que se le está administrando es eficaz para evitar complicaciones severas y muerte por SARS CoV-2 COVID-19 en la gestante, en el feto o neonato.
A la fecha no hay pruebas que la vacuna cause efectos adversos diferentes a los observados en la población general importantes para la mujer embarazada, el feto o la placenta.
A nivel poblacional son muchos mayores los beneficios de administrar el biológico, sobre los riesgos de llegar a padecer COVID-19 durante la gestación, por el impacto que sobre la salud materna y perinatal produce la infección por SARS-CoV-2 y ante el alto riesgo de complicaciones severas, ingreso a UCI, morbilidad y mortalidad materna y fetal asociada a esta enfermedad.
Manifiesto que soy mujer con más de 12 semanas de gestación o que me encuentro dentro de los 40 días posparto y realicé previamente la evaluación riesgo – beneficio junto con mi médico.
EXPRESIÓN DE LA VOLUNTAD
De manera voluntaria, después de haber recibido información por el personal de salud clara, concreta, sencilla y en términos acordes con mi condición, así como las explicaciones adecuadas, informo que comprendo los beneficios, riesgos, alternativas e implicaciones de la aplicación de la vacuna que se me ofrece. De la misma manera, se me han indicado las recomendaciones que debo seguir, de acuerdo con la información entregada por el laboratorio productor de la vacuna.
Entiendo que la suscripción de este documento constituye una expresión autónoma de mi voluntad, y que NO tiene por objeto eximir de responsabilidad a las autoridades sanitarias o gubernamentales ni a las entidades que participaron en la aplicación de la vacuna contra el SARS-CoV-2/COVID-19 de brindar la atención en salud que sea necesaria por la aparición de posibles reacciones adversas no reportadas.
En consecuencia, decido ACEPTAR: ___ que se me aplique la vacuna. NO ACEPTAR: ___ que se me aplique la vacuna.
Firma de la persona: ______________________________
En caso de requerirse, identificación y firma del representante legal:
Nombres____________________________________
Apellidos____________________________________
Tipo de Identificación: - CC__ CE__ OTRO___ Número __________________
Firma ___________________________
En caso de requerirse firma a ruego:
En virtud de que la persona a vacunar ________________________________ ________, identificado(a) con CC__ CE__ OTRO_________ Número _________ de ____________ no sabe o no puede firmar, a su ruego firma ___________________________________________ identificado(a) con CC__ CE__ OTRO___ número_________ de _________________

________________________________ ________________________ __________
Huella dactilar o plantar del rogante Firma del rogado
C.C. ___________________ C.C. _____________________
Nombres y apellidos del vacunador _________________________________
______________
Firma ________________________
Tipo de Identificación: CC__CE__OTRO__ Número____________________
DATOS DE LA INSTITUCIÓN
INSTITUCIÓN PRESTADORA DE SERVICIOS SALUD (IPS) ___________ ____________________________
DEPARTAMENTO/DISTRITO________________________________MUNICIPIO: ______________________
Nota: Los menores de edad deben firmar junto con uno de sus padres o su representante legal.
Tipos de documentos de identidad: RC: Registro Civil, TI: Tarjeta de Identidad, CC: Cédula de ciudadanía, CE: Cédula de extranjería"
ANEXO TÉCNICO PARA LA APLICACIÓN DE LA VACUNA MODERNA RNAm-1273 CONTRA LA COVID-19
Generalidades de la vacuna
La vacuna elaborada por Switzerland GMBH contra la Covid-19 denominada Moderna ARNm-1273 es ARN mensajero monocatenario producido mediante transcripción in vitro acelular, que codifica la proteína de la espícula (S) viral del SARS-CoV-2.
La vacuna estimula las defensas naturales (sistema inmunitario) y funciona haciendo que el organismo genere protección (anticuerpos) contra el virus que causa la Covid-19. Utiliza el ARNm para transportar las instrucciones con las cuales las células producen la proteína de espículas que se encuentra en el virus. Luego, las células del sistema inmunitario son estimuladas para fabricar anticuerpos contra la proteína de las espículas para luchar contra el virus y proteger a la persona vacunada contra la Covid-19 (1).
La vacuna contiene los siguientes excipientes: lípido SM-102, colesterol, 1,2-diestearoil-sn-glicero-3-fosfocolina (DSPC), 1,2-dimiristoil-rac-glicero-3- metoxipolietilenglicol-2000 (PEG2000 DMG), trometamol, clorhidrato de trometamol, ácido acético, acetato de sodio trihidrato, sacarosa, agua para preparaciones inyectables.
Presentación, forma farmacéutica e indicación terapéutica
Presentación:
• Caja por 10 viales multidosis, las cuales pueden venir con las siguientes dosis:
• Vial multidosis con un contenido de 10 dosis de 0,5 ml.
• Vial multidosis con un contenido máximo de 11 dosis: Rango de 10 a 11 dosis (0,5ml cada una).
• Vial multidosis con un contenido máximo de 15 dosis: Rango de 13 a 15 dosis (0,5ml cada una).
• Una dosis (0,5 ml) contiene 100 microgramos de ARN mensajero (ARNm) (encapsulado en nanopartículas lipídicas SM-102).
Forma farmacéutica:
• Concentrado dispersión inyectable.
• La vacuna es un líquido de color blanco o blanquecino (pH: 7,0 – 8,0) tanto en el vial como en la jeringa.
Indicaciones terapéuticas:
• Inmunización activa para prevenir la Covid-19 causado por el virus del SARS-CoV-2, en personas de 6 años o más. Esta vacuna debe utilizarse conforme a las recomendaciones del fabricante.
Conservación
Periodo de validez
• Vial sin abrir
| • Conservada congelada entre -25°C y -15°C tiene una duración de 9 meses. • Una vez descongelada, la vacuna no se debe volver a congelar. • Se debe mantener la cadena de frío y evitar la exposición de los viales a la luz solar y ultravioleta. • La vacuna debe descongelarse antes de su administración. • Después de descongelar, se pueden extraer 10 dosis de 0,5 ml cada una o 20 dosis de 0.25 ml de cada vial. |  |
| • Los viales de la vacuna sin abrir pueden almacenarse refrigerados de +2°C a +8 °C, protegida de la luz, durante un máximo de 30 días antes de retirar la primera dosis. 7 La vacuna sin abrir, tras extraerla de las condiciones de refrigeración puede almacenarse entre 8 °C y 25 °C durante 24 horas. |  |
• Vial perforado
| • La estabilidad química y física en uso ha sido demostrada durante 19 horas entre 2°C y 25 °C después de la primera perforación (dentro del periodo de uso permitido de 30 días entre 2°C y 8°C y de 24 horas entre 8°C y 25°C). • Desde un punto de vista microbiológico, el medicamento debe utilizarse de inmediato. Si la vacuna no se utiliza inmediatamente, los tiempos y las condiciones de conservación durante el uso son responsabilidad del usuario. |  |
Eficacia
Se ha demostrado que la vacuna ARNm-1273 contra Covid-19 desarrollada por Moderna tiene una eficacia del 94,1%, según una mediana de seguimiento de dos meses. Se mantuvo una alta eficacia en todos los grupos de edad (mayores de 18 años) y no se vio afectada por el sexo o la etnia. Los datos revisados por la OMS en este momento respaldan la conclusión de que los beneficios conocidos y potenciales del ARNm-1273 superan los riesgos conocidos y potenciales (2–4).
La eficacia frente a la Covid-19 severa fue del 100% (IC=95%).
Dosis, vía, y sitio de administración en niños de 6 a 11 años de edad (4, 5 y 11)
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,25 ml | Intramuscular Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. | |
| 2ª dosis (28 días después de aplicada la primera dosis) | |||
Dosis, vía, y sitio de administración en personas de 12 años de edad y mayores (4,5)
| No. de dosis | Dosis | Vía de aplicación | Sitio de aplicación |
| 1ª dosis (Considérese día 0) | 0,5 ml | Intramuscular | Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho. |
| 2ª dosis (28 días después de aplicada la primera dosis) |
Nota: No inyectar la vacuna por vía intravascular, subcutánea o intradérmica
Administración (4,6)
• La serie de vacunas de Moderna ARNm-1273 en personas mayores de 12 años consta de dos dosis administradas por vía intramuscular cada una de 0,5 ml.
• La serie de vacunas de Moderna ARNm-1273 en niños de 6 a 11 años consta de dos dosis administradas por vía intramuscular cada una de 0,25 ml.
• La población mayor de 6 años se aplicará la segunda dosis con un intervalo de 28 días y no antes; sin embargo, las segundas dosis administradas dentro de un período de gracia de 4 días antes de la fecha recomendada para la segunda dosis aún se consideran válidas.
• La vacuna no debe mezclarse en la misma jeringa con otras vacunas u otros medicamentos.
• El fabricante no ha evaluado la seguridad o eficacia de la vacuna de Moderna ARNm-1273 fuera de los intervalos evaluados en el estudio de fase III.
• El fabricante no sugiere ni recomienda el uso de la vacuna Moderna RNAm- 1273 de cualquier otra manera que no sea la descrita en documento regulatorio aprobado localmente.
Intercambiabilidad (4,6)
• La información de que se dispone sobre la intercambiabilidad de la vacuna Moderna RNAm-1273 con otras vacunas de ARNm u otras plataformas de vacuna Covid-19 para completar la serie de vacunación es limitada a la fecha. La vacunación con esquemas heterólogos (productos diferentes en cada dosis del esquema) debe limitarse a personas con inmunosupresión (descritas en el numeral 8.2.).
• Se recomienda que ambas dosis de la serie deben completarse con el mismo producto.
• En situaciones excepcionales en las que el producto de la vacuna de ARNm administrado para la primera dosis no se puede determinar o ya no está disponible, se puede administrar cualquier vacuna de ARNm Covid-19 disponible en un intervalo mínimo de 28 días entre dosis para completar la serie de vacuna de ARNm Covid-19.
• Si se administran dos dosis de diferentes productos de la vacuna de ARNm Covid-19 en estas situaciones (o inadvertidamente), no se recomiendan dosis adicionales de ninguno de los productos en este momento. Estas personas se consideran completamente vacunadas contra Covid-19 = 2 semanas después de recibir la segunda dosis de una vacuna de ARNm.
Coadministración con otras vacunas
• No hay datos que permitan evaluar la administración concomitante de la vacuna de Moderna ARNm-1273 con otras vacunas.
• Se desconoce si la reactogenicidad de la vacuna Covid-19 aumenta con la coadministración, incluso con otras vacunas que se sabe que son más reactogénicas.
• Si bien los estudios de coadministración están en curso, según el CDC, las vacunas Covid-19 y otras vacunas ahora se pueden administrar al mismo tiempo. Esto incluye la administración simultánea de vacunas Covid-19 y otras vacunas el mismo día, así como dentro de los 14 días.
• Si la vacuna de Moderna ARNm-1273 se administra simultáneamente con otras vacunas inyectables, estas deben administrarse en diferentes sitios de inyección.
• No mezcle la vacuna de Moderna ARNm-1273 con ninguna otra vacuna en la misma jeringa.
Preparación de la vacuna
Procedimiento para la descongelación de la vacuna
• El vial multidosis se almacena congelado y debe descongelarse antes de su uso.
• La caja térmica de Moderna ARN-m 1273 contiene 10 viales multidosis de vacuna congelados (10 dosis cada uno).
• Una vez abierta, descongelar los viales introduciéndolos al refrigerador para descongelarlos a una temperatura de +2°C a +8°C, alrededor de 2 horas y 30 minutos o dejar el vial 1 hora a temperatura ambiente (entre 15°C y 25 °C).
• Antes de administrar la vacuna dejar el vial a temperatura ambiente durante 15 minutos y marcar el vial con la fecha y hora de descongelación (Nota: NO descongelar los viales desde el día anterior).
Procedimiento para la administración de la vacuna
• La vacuna debe ser administrada por un profesional sanitario mediante técnicas asépticas para garantizar la esterilidad del procedimiento.
• Inicialmente realice lavado o higiene de manos.
• La vacuna está lista para usarse una vez descongelada.
• Verifique que el líquido tiene un color blanco o blanquecino tanto en el vial como en la jeringa.
• La vacuna puede contener partículas blancas o transparentes relacionadas con el producto.
• Gire el vial suavemente después de la descongelación y antes de cada extracción. No agitar ni sacudir.
• Una vez descongelado el vial de la vacuna se pueden extraer diez (10) dosis (de 0,5 ml cada una).
• Una vez descongelado el vial de la vacuna NO volver a congelar.
• Extraiga la dosis de 0,5 ml de vacuna con una aguja y una jeringa estériles de 1 ml (22G o 23G) convencional o auto descartable según disponibilidad y deseche cualquier vacuna no utilizada dentro de las 19 horas posteriores a la extracción de la primera dosis.
• Si la dosis es incorrecta, o hay un cambio de color y otras partículas presentes, no se debe administrar la vacuna.
• Se incluye un sobrellenado adicional en cada vial para garantizar que puedan administrarse 10 dosis de 0,5 ml. No acumule el exceso de vacuna de múltiples viales.
Nota: Verificar visualmente la apariencia del biológico, observar si la mezcla es diferente a la indicada por el fabricante si es así siga el siguiente flujo de información:
1. Reporte al coordinador del punto de vacunación su hallazgo.
2. No utilice el vial, sepárelo y márquelo como cuarentena.
3. Realice un video del vial, evidenciando su hallazgo.
4. Realice el reporte al coordinador municipal, por correo electrónico indicando lote y fabricante y envíe la evidencia.
5. Reporte al nivel municipal y/o departamental/distrital.
6. El nivel departamental/distrital reportará a este Ministerio vía telefónica a través de los teléfonos del CNE para PAI y enviará el reporte a través del correo electrónico establecido para tal fin
7. Este Ministerio informará al Invima, así como al fabricante el reporte de los hallazgos.
8. Una vez se cuente con el concepto por parte del fabricante, se informará a la entidad territorial.
• Al finalizar la jornada diaria se deben identificar las dosis sobrantes por inasistencia de personas a las citas o disminución del cálculo de la pérdida por frasco abierto.
• Posteriormente, identificar la población que no se encuentre vacunada y aplicar la vacuna priorizando según fase y etapa en la cual se está desarrollando la vacunación. Si es el caso, usar la(s) dosis en personas incluidas en la siguiente etapa.
• Es importante mencionar que todas las personas a vacunar estén agendadas o no, deben seguir todo el proceso de vacunación, que incluye entre otros, diligenciar y firmar del consentimiento informado, recibir la información relacionada con la vacuna, permanecer el tiempo asignado en las instalaciones posterior a la vacunación según su condición, registrar la información en el PAIWEB y recibir el carné de vacunas.
Técnica para aplicar la vacuna
• Descubra el sitio de aplicación. Músculo deltoides idealmente del brazo izquierdo a menos que por alguna situación particular se requiera aplicar en el brazo derecho.
• Realice limpieza de arriba hacia abajo o en forma circular del centro a la periferia con una torunda de algodón sin pasar por el mismo sitio.
• Retire la funda protectora o capuchón de la aguja para aplicar la vacuna.
• Con una mano estire la piel con los dedos pulgar e índice.
• Con la otra mano tome la jeringa, con el bisel de la aguja hacia arriba en un ángulo de 90° sobre el plano de la piel.
• Introduzca la aguja por vía intramuscular.
• Presione el émbolo para que penetre la vacuna.
• Fije ligeramente la piel con una torunda seca, cerca del sitio donde está inserta la aguja, y retire la jeringa inmediatamente después de haber introducido el líquido.
• Estire la piel para perder la luz del orificio que dejó la aguja.
• Presione por 30 a 60 segundos con la torunda, sin dar masaje. Al concluir el procedimiento, realice la higiene de manos.
Contraindicaciones
• Un historial de anafilaxia a cualquier componente de la vacuna es una contraindicación para la vacunación.
• La vacuna Moderna RNAm-1273 no debe administrarse a personas con antecedentes de anafilaxia al polietilenglicol (PEG), uno de los componentes de la vacuna.
• Si se produce anafilaxia después de la primera dosis, no se debe administrar una segunda dosis de la vacuna ARNm-1273 o de ARNm-BNT162b2 (Pfizer).
Precauciones
• Un historial de anafilaxia a cualquier otra vacuna o terapia inyectable (es decir, vacunas o terapias intramusculares, intravenosas o subcutáneas) se considera una precaución, pero no una contraindicación para la vacunación. Para estas personas, un profesional de la salud con experiencia especializada en trastornos alérgicos debe realizar una evaluación de riesgos. Estas personas aún pueden recibir la vacuna. Aún es incierto si existe un mayor riesgo de anafilaxia, pero deben ser asesorados sobre el riesgo potencial de anafilaxia y los riesgos deben sopesarse con los beneficios de la vacunación. Estas personas deben ser observadas durante 30 minutos después de la vacunación en entornos de atención médica donde la anafilaxia se puede tratar de inmediato.
• Las personas con una reacción alérgica no anafiláctica inmediata, definida esta como signo o síntoma, como urticaria, angioedema o síntomas respiratorios sin ningún otro síntoma (tos, sibilancias, estridor), que se presente dentro de las 4 horas posteriores a la administración de la primera dosis no deben recibir dosis adicionales, a menos que se recomiende después de una revisión por parte de un profesional de la salud con experiencia especializada. Sin embargo, sujeto a la evaluación individual de riesgo-beneficio, el ARNm-1273 podría proporcionarse bajo una estrecha supervisión médica si es la única opción disponible para personas con alto riesgo de Covid-19 grave.
• Se ha informado de un pequeño número de reacciones anafilácticas en vacunados sin antecedentes de anafilaxia. Por lo anterior, la OMS recomienda que la vacuna ARNm- 1273 se administre solo en entornos donde se pueda tratar la anafilaxia. Hasta disponer de más datos y conocimientos con respecto a la anafilaxia después de la vacunación con ARNm-1273, todos los vacunados deben ser observados durante al menos 15 minutos después de la vacunación.
• Los alimentos, el veneno de insectos, las alergias por contacto, la rinitis alérgica, el eccema y el asma no se consideran una precaución. Los tapones de los viales no están hechos con látex de caucho natural y no hay contraindicaciones ni precauciones para la vacunación de personas con alergia al látex. Además, como el ARNm-1273 no contiene huevos ni gelatina, no existe ninguna contraindicación o precaución para la vacunación de personas con alergia a cualquier sustancia alimentaria.
• Cualquier persona con una enfermedad febril aguda (temperatura corporal superior a 38,5°C) debe posponer la vacunación hasta que esté afebril.
• Ver la evaluación según el riesgo en la siguiente tabla.
Evaluación de personas candidatas a la vacunación frente a la Covid-19 de Moderna
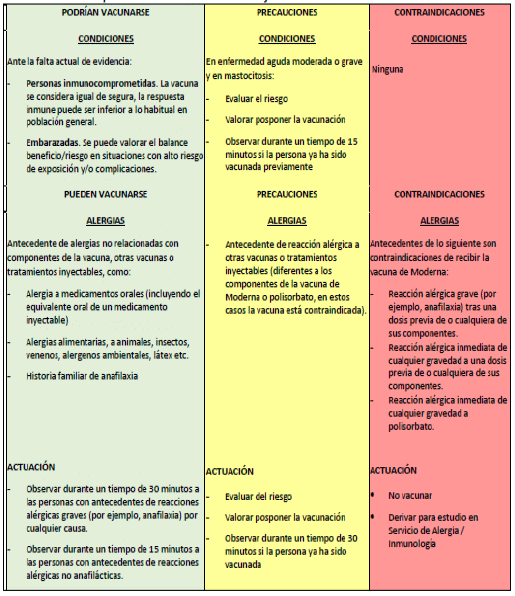
Fuente: Dirección General de Salud Pública (Consejería de Sanidad) (7)
Advertencias y precauciones especiales de empleo (8,9)
Trazabilidad
Con objeto de mejorar la trazabilidad de los medicamentos biológicos, el nombre y el número de lote del medicamento administrado deben estar claramente registrados.
• Antes de vacunar lea cuidadosamente el inserto o indicación para prescribir que trae adjunto cada una de las vacunas.
• Se pueden producir reacciones relacionadas con ansiedad, incluidas reacciones vasovagales (síncope), hiperventilación o reacciones relacionadas con estrés, asociadas al acto vacunal como respuesta psicógena a la inyección con aguja. Es importante tomar precauciones para evitar lesiones a causa de un desmayo.
• La vacunación se debe posponer en personas que presenten una enfermedad febril aguda grave o una infección aguda. La presencia de una infección leve y/o de fiebre de baja intensidad no debe posponer la vacunación.
• Como sucede con otras inyecciones intramusculares, la vacuna debe administrarse con precaución a las personas que reciban tratamiento anticoagulante o a aquellas que presenten trombocitopenia o padezcan un trastorno de la coagulación (como hemofilia) debido a que en estas personas se puede producir sangrado o formación de hematomas tras una administración intramuscular.
• No se ha evaluado la eficacia, la seguridad ni la inmunogenicidad de la vacuna en personas inmunodeprimidas, incluidas aquellas que estén recibiendo tratamiento inmunosupresor. La eficacia de la vacuna puede ser menor en personas inmunodeprimidas.
• Se desconoce la duración de la protección proporcionada por la vacuna, ya que todavía se está determinando en ensayos clínicos en curso.
• Las personas pueden no estar totalmente protegidas hasta 14 días después de la segunda dosis. Como con cualquier vacuna, la vacunación con Moderna ARNm-1273 puede no proteger a todas las personas que la reciban.
• No se dispone de datos sobre la seguridad y eficacia del ARNm-1273 en personas con afecciones autoinmunes, aunque estas personas fueron elegibles para la inscripción en los ensayos clínicos. Las personas con enfermedades autoinmunes que no tienen contraindicaciones para la vacunación pueden vacunarse.
• Las personas inmunodeprimidas, incluidas las personas que reciben terapia inmunosupresora, pueden tener una respuesta inmunitaria disminuida a la vacuna. No hay datos disponibles sobre el uso concomitante con inmunosupresores.
• Personas con inmunosupresión severa por cualquier causa (incluye personas con VIH no controlado), pueden vacunarse, aunque la respuesta inmunológica por su estado podría no garantizar la eficacia demostrada de la vacuna.
Vacunación de poblaciones específicas (4)
Poblaciones para las que se dispone de datos de apoyo de ensayos clínicos de fase 2/3
Personas mayores
• El riesgo de Covid-19 severo y muerte aumenta abruptamente con la edad. Los datos del ensayo de fase 3 indican que la eficacia y la seguridad de la vacuna son comparables en todos los grupos de edad (mayores de 18 años).
• Se recomienda la vacunación para las personas mayores sin un límite de edad. Los estudios de efectividad de la vacuna posteriores a la introducción han demostrado una alta efectividad y buenos perfiles de seguridad en este grupo de edad.
Personas con comorbilidades
• Se han identificado ciertas comorbilidades que aumentan el riesgo de enfermedad grave por Covid-19 y muerte. El ensayo clínico de fase 3 demostró que la vacuna tiene perfiles de seguridad y eficacia similares en personas con diversas afecciones médicas subyacentes, incluidas aquellas que las ponen en mayor riesgo de Covid-19 grave. Las comorbilidades estudiadas en el ensayo clínico de fase 3 incluyeron enfermedad pulmonar crónica, enfermedad cardíaca significativa, obesidad grave, diabetes, enfermedad hepática e infección por el virus de la inmunodeficiencia humana (VIH).
Poblaciones para las que existen datos limitados o nulos del ensayo clínico de fase 3
Población pediátrica
No se ha establecido todavía la seguridad y la eficacia de Spikevax en niños y adolescentes de menos de 6 años. No se dispone de datos.
Mujeres embarazadas
• La experiencia con el uso de la vacuna Covid-19 Moderna ARNm-1273 en mujeres embarazadas es limitada. Los estudios realizados en animales no sugieren efectos perjudiciales directos ni indirectos con respecto al embarazo, el desarrollo embriofetal, el parto o el desarrollo posnatal, por lo que por ahora esta población no será incluida en la vacunación contra la Covid-19 con esta vacuna.
• Los estudios de toxicología reproductiva y del desarrollo completados en animales no han mostrado efectos nocivos de la vacuna durante el embarazo.
• Actualmente no se dispone de datos de ensayos clínicos sobre seguridad e inmunogenicidad en el embarazo. Hasta el momento, los datos de farmacovigilancia de la vacuna posteriores a la introducción no han identificado ningún problema agudo de seguridad, con un perfil de reactogenicidad y eventos adversos similar al informado en ausencia de embarazo.
Personas que viven con el VIH
• Las personas que viven con el VIH pueden tener un mayor riesgo de contraer Covid-19 grave.
• La vacuna no es un virus vivo, las personas que viven con el VIH que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
• Las personas VIH positivas que están bien controladas con terapia antirretroviral de gran actividad son parte de un grupo recomendado para la vacunación.
• Los datos disponibles sobre la administración de la vacuna son actualmente insuficientes para permitir la evaluación de la eficacia o seguridad de esta frente a las personas que viven con el VIH que no están bien controladas con la terapia. Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
• Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y beneficios. No es necesario realizar una prueba de infección por VIH antes de la administración de la vacuna.
Personas inmunodeprimidas
• Las personas inmunodeprimidas tienen un mayor riesgo de contraer Covid-19 grave.
• Actualmente, los datos disponibles son insuficientes para evaluar la eficacia de la vacuna o los riesgos asociados a la vacuna en personas gravemente inmunodeprimidas.
• Es posible que la respuesta inmunitaria a la vacuna se reduzca, lo que puede alterar su eficacia.
• La vacuna no es un virus vivo, las personas inmunodeprimidas que forman parte de un grupo recomendado para la vacunación pueden vacunarse.
• Se debe proporcionar información y, cuando sea posible, asesoramiento sobre los perfiles de eficacia y seguridad de las vacunas en personas inmunodeprimidas para fundamentar la evaluación individual de los riesgos y los beneficios.
Personas que han tenido previamente una infección por SARS-CoV-2
• No se recomiendan las pruebas virales o serológicas para detectar una infección previa con el fin de tomar decisiones sobre la vacunación.
• Los datos de los análisis combinados indican que la vacuna es segura en personas con evidencia de infección previa por SARS-CoV-2.
• Las personas con antecedente de Covid-19 confirmado, en el marco del PNV contra la Covid-19 serán vacunadas noventa (90) días contados a partir del inicio de síntomas en personas sintomáticas y a partir de la toma de muestra en personas asintomáticas.
Personas con Covid-19 agudo actual
• Las personas con Covid-19 aguda confirmada por PCR no deben vacunarse hasta que se hayan recuperado de la enfermedad aguda y se hayan cumplido los criterios para la interrupción del aislamiento. Aún no se conoce el intervalo óptimo entre una infección natural y la vacunación.
Personas que previamente recibieron terapia con anticuerpos pasivos para la Covid-19.
• Actualmente no hay datos sobre la seguridad o eficacia de la vacunación en personas que recibieron anticuerpos monoclonales o plasma de convalecencia como parte del tratamiento con Covid-19.
• La vacunación debe posponerse durante al menos 90 días para evitar la interferencia del tratamiento con anticuerpos con las respuestas inmunitarias inducidas por la vacuna.
Reacciones adversas esperadas (2,5)
• Según el resumen del perfil de los estudios de seguridad de la vacuna Moderna ARNm-1273, las reacciones adversas notificadas con más frecuencia fueron tanto las locales como las sistémicas; más con la segunda dosis: dolor en el lugar de la inyección (92%), fatiga (70%), cefalea (64,7%), mialgia (61,5%), artralgia (46,4%), escalofríos (45,4%), náuseas/vómitos (23%), hinchazón/sensibilidad axilar (19,8%), fiebre (15,5%), edema en el lugar de la inyección (14,7%) y enrojecimiento (10%). Las reacciones adversas fueron, por lo general, de intensidad leve o moderada y se resolvieron entre 4 y 5 días después de la vacunación, donde se enrolaron participantes mayores de 18 años. En las personas de mayor edad se asoció a una frecuencia ligeramente menor de acontecimientos de reactogenicidad.
• La frecuencia de eventos adversos de grado 3 en el grupo de placebo (1,3%) fue similar a la del grupo de vacuna (1,5%), al igual que las frecuencias de eventos adversos atendidos médicamente (9,7% frente a 9,0%) y eventos adversos graves (0,6% en ambos grupos).
• Se informaron reacciones de hipersensibilidad en el 1,5% y el 1,1% de los participantes en los grupos de vacuna y placebo, respectivamente.
• Parálisis de Bell se produjo en el grupo de la vacuna (3 participantes (<0,1%)) y el grupo de placebo (1 participante (<0,1%)) durante el período de observación del ensayo (más de 28 días después de la inyección).
• En general, el 0,5% de los participantes en el grupo de placebo y el 0,3% en el grupo de ARNm-1273 tuvieron eventos adversos que provocaron que no recibieran la segunda dosis, y menos del 0,1% de los participantes de ambos grupos interrumpieron su participación en el ensayo por eventos adversos después de cualquier dosis.
• No se observó evidencia de enfermedad respiratoria aumentada asociada a la vacuna.
• Se observaron menos casos de Covid-19 grave o cualquier Covid-19 entre los participantes que recibieron ARNm-1273 que entre los que recibieron placebo. Los eventos adversos que el equipo del ensayo consideró que estaban relacionados con la vacuna o el placebo se informaron entre el 4,5% de los participantes en el grupo de placebo y 8,2% en el grupo ARNm-1273.
Sobredosis
No se han notificado casos de sobredosis. En caso de sobredosis, se recomienda vigilar las funciones vitales y un posible tratamiento sintomático.
Interacción con otros medicamentos y otras formas de interacción
• No se han realizado estudios de interacción. No se ha estudiado la administración concomitante de la vacuna de ARNm-1273 con otras vacunas.
• No mezclar la vacuna ARNm-1273 con otras vacunas / productos en la misma jeringa.
Efectos sobre la capacidad para conducir y utilizar máquinas
La vacuna Moderna ARNm-1273 tiene una influencia nula o insignificante sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunas de las reacciones adversas pueden afectar temporalmente a la capacidad para conducir o utilizar máquinas.
Vacunación segura
Antes de recibir la vacuna Moderna ARNm-1273 debe preguntar a la persona a vacunar sobre todas sus condiciones médicas, incluyendo si usted:
• Tiene alguna alergia. Es importante indagar al usuario si ha presentado reacción alérgica grave.
• Si alguna vez se ha desmayado después de una inyección con aguja.
• Tiene fiebre
• Tiene problemas de hemorragia o hematomas, o si está tomando un medicamento anticoagulante (para prevenir la formación de coágulos de sangre).8
• Si su sistema inmunológico no funciona correctamente (inmunodeficiencia) o si está tomando medicamentos que debilitan el sistema inmunológico (como corticosteroides en dosis altas, inmunosupresores o medicamentos contra el cáncer).
• Ha recibido otra vacuna contra la Covid-19
• En caso de ser mujer en edad reproductiva preguntar:
- Está embarazada o planea quedar embarazada
- Está amamantando
• Ha recibido otra vacuna contra la Covid-19
Nota: Ver ítem contraindicaciones
Referencias
1. Wang F, Kream RM, Stefano GB. An evidence based perspective on mRNA-SARS-CoV-2 Vaccine Development. Med Sci Monit. 2020;26:1–8.
2. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020;403–16.
3. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against Covid-19. 2021;(January):1–8. Available from: https:// apps.who.int/iris/bitstream/handle/10665/338862/WHO-2019-nCoV-vaccines-SAGE_ recommendation-mRNA-1273-2021.1-eng.pdf?sequence=1&isAllowed=y
4. World Health Organization. Interim recommendations for use of the Moderna mRNA-1273 vaccine against Covid-19. Update 15 June. World Heal Organ [Internet]. 2021;1–11. Available from: WHO/2019-nCoV/vaccines/SAGE_recommendation/ BNT162b2/2021.1
5. Invima. Resolución No. 2021025857 de 25 de junio de 2021. Autorización Sanitaria de Uso de Emergencia (ASUE) para la Covid-19 Vaccine Moderna Switzerland GMBH. 2021;1–20.
6. Centers for Disease Control Prevention. Interim Clinical Considerations for Use of mRNA Covid-19 Vaccines Currently Authorized in the United States [Internet]. 2021 [cited 2021 Jan 18]. Available from: https://www.cdc.gov/vaccines/covid-19/info-by-product/clinical-considerations.html?CDC_AA_refVal=https%3A%2F%2Fwww. cdc.gov%2Fvaccines%2Fcovid-19%2Finfo-by-product%2Fpfizer%2Fclinical-considerations.html#Administration
7. Dirección General de Salud Pública (Consejería de Sanidad). Anexo 2. Vacuna Covid-19 ARNm, Moderna. Comunidad de Madrid. 2021;1–9.
8. European Medicines Agency (EMA). Ficha técnica o resumen de las características del producto Covid-19 Vaccine Moderna. 2021;1–27.
9. Food and Drug Administration. Fact sheet for healthcare providers administering vaccine (vaccination providers) emergency use authorization (EUA) of The moderna Covid-19 vaccine to prevent coronavirus disease 2019 (Covid-19). 2020;1–22. Available from: https://search.bvsalud.org/global-literature-on-novel-coronavirus-2019-ncov/ resource/en/grc-740221
10. Instituto Nacional de Salud-Grupo de enfermedades transmisibles. Farmacovigilancia de vacunas. (Evento adverso posterior a la vacunación). Código: 298 Equipo de Inmunoprevenibles. [Internet]. 2021. Available from: https://www.ins.gov.co/ buscador-eventos/Lineamientos/farmacovigilancia-vacunas-05-03-2021.pdf
11. Invima. Resolución No. 2022019162 de 24 de junio de 2022. Autorización Sanitaria de Uso de Emergencia (ASUE) para la Covid-19 Vaccine Moderna Switzerland GMBH. 2021;1–20.



