 BUSCAR
BUSCAR
 ÍNDICE
ÍNDICE
RESOLUCIÓN 00002451 DE 2024
(diciembre 2)
Diario Oficial No. 52.958 de 2 de diciembre de 2024
Diario Oficial disponible en la web de la Imprenta 11/12/2024
MINISTERIO DE SALUD Y PROTECCIÓN SOCIAL
<Vigente hasta tanto se garantice el abastecimiento de medicamentos en el país sin que supere el 31 de diciembre del año 2024>
Por la cual se modifica parcial y transitoriamente los esquemas terapéuticos usando dosis fija combinada establecidos en la Resolución número 227 de 2020 y se dictan otras disposiciones.
EL MINISTRO DE SALUD Y PROTECCIÓN SOCIAL,
en ejercicio de sus facultades legales, en especial las previstas en los numerales 3, 4 y 7 del artículo 2o del Decreto Ley 4107 de 2011, el numeral 3 del artículo 173 de la Ley 100 de 1993 y 42.3 del artículo 42 de la Ley 715 de 2001 y,
CONSIDERANDO:
Que el artículo 5o de la Ley 1751 de 2015 dispone que el Estado es responsable de respetar, proteger y garantizar el goce efectivo del derecho fundamental a la salud, como uno de los elementos fundamentales del Estado social de de recho.
Que, de acuerdo con el artículo 2o de la Ley 1438 de 2011 el bienestar del usuario es el eje central y núcleo articulador de las políticas en salud.
Que en el numeral 42.13 del artículo 42 de la Ley 715 de 2001 establece que le corresponde a la Nación como responsable de la dirección del sector salud y del Sistema General de Seguridad Social en Salud en el territorio nacional: “Adquirir, distribuir y garantizar el suministro oportuno de los biológicos del Plan Ampliado de Inmunizaciones (PAI), los insumos críticos para el control de vectores y los medicamentos para el manejo de los esquemas básicos de las enfermedades trasmisibles y de control especial”.
Que mediante la Resolución número 5195 de 2010 se estableció que el Comité Asesor Nacional de Tuberculosis es la instancia asesora a nivel nacional y territorial para el desarrollo de acciones encaminadas a prevenir, vigilar y controlar la tuberculosis, la coinfección TB-VIH, la tuberculosis multidrogorresistente MDR y extremadamente resistente XDR y demás condiciones que incidan para el control de la enfermedad, y dentro de sus funciones, artículo 2o, se contempla “1. Recomendar políticas, estrategias y medidas que considere necesarias para la prevención y control de tuberculosis. 2. Proponer cambios operativos al desarrollo del Programa Nacional de Control de Tuberculosis”.
Que en la Resolución número 227 de 2020 se adoptaron los lineamientos técnicos y operativos como parte del Programa Nacional de Prevención y Control de la Tuberculosis (PNPCT) y en el capítulo 4, se fijaron las directrices y recomendaciones para el tratamiento de la enfermedad tuberculosa activa y en el anexo 4 se establecieron los esquemas terapéuticos recomendados para la enfermedad tuberculosa activa y la infección tuberculosa latente.
Que, la rifampicina es el principal componente del tratamiento para la tuberculosis sensible y se usa en dosis fija combinada tetraconjugado (RHZE). Sin embargo, la Organización Panamericana de la Salud informó sobre la escasez del ingrediente activo para producirla por el cierre repentino de la principal fábrica productora en la China. Por lo tanto, la nueva producción tiene retrasos que generan desabastecimiento a nivel global de las combinaciones de medicamentos de a base de dosis fijas combinadas que contienen Rifampicina con otros antituberculosos en las formulaciones para adultos y pediátricas.
Que, este Ministerio ha desarrollado las acciones de gestión para procesos de donación entre países de la región de las Américas, sin embargo, los procesos no dan respuesta inmediata a la situación que se presenta, además que la escasez de Rifampicina afecta también a la región.
Que, se han coordinado estrategias de redistribución de estos medicamentos entre entidades territoriales, y se logró el abastecimiento temporal. Sin embargo, a 15 de noviembre las entidades que aportan la mayor frecuencia de casos al país no tienen capacidad de respuesta por la falta de tetraconjugado para adul tos (RHZE).
Que, frente a lo anterior, se establecieron alternativas terapéuticas que incluyen Rifampicina-Isoniazida en dosis fija combinada (RH) y dosis individuales de Pirazinamida (Z) y Etambutol (E).
Que, en el Ministerio y en las entidades territoriales existen cantidades suficientes hasta el mes de diciembre de Rifampicina-Isoniazida en dosis fija combinada (RH) y Pirazinamida (Z). Sin embargo, el cuarto medicamento requerido (dosis individual de Etambutol-E) es insuficiente para atender la demanda para garantizar el tratamiento hasta la fecha en que se haga efectiva la entrega de medicamento adquirido a través del Fondo Estratégico de la Or ganización Panamericana de la Salud.
Que, teniendo en cuenta lo anterior, y frente a la proporción de casos que se presentan anualmente y el incremento observado durante el último año, actualmente no existen suficientes unidades para atender los casos que se p resenten.
Que, en sesiones extraordinarias el Comité Asesor Nacional de Tuberculosis el 11 de octubre y 1 de noviembre de 2024 se reunió a fin de establecer nuevas medidas terapéuticas que permitan tratar sin perjuicio la salud de las personas afectadas por tuberculosis considerando los diferentes escenarios de abastecimiento nacional de medicamentos.
Que, en el Comité Asesor Nacional del Tuberculosis, sesión del 16 de febrero del año en curso se planteó la incorporación de los esquemas cortos 100% orales con base a las recomendaciones de la OMS, avaladas para ser incluidos en la compra centralizada de medicamentos de segunda línea para la vigencia, haciendo una transición gradual y evaluación de casos candidatos, con el fin de acortar los esquemas pasando de 20 meses a 9 meses, en consonancia con la nota técnica emitida por la OMS de junio de 2024.
Que, el comportamiento epidemiológico de la TB MDR/RR muestra una tendencia al incremento sobre las estimaciones nacionales y para cubrir las necesidades del linezolid para el tratamiento de la TB MDR/RR es necesario que las Entidades Administradoras de Planes de Beneficios de Salud, los administradores de los regímenes Especial y de Excepción y responsables de aseguramiento de la población pobre no afiliada adquieran los medicamentos de acuerdo a lo contenido en la Resolución número 2366 de 2023.
Que, la Resolución número 2366 de 2023, incluye tecnologías que permiten determinar la sensibilidad a medicamentos antituberculosis de acuerdo con los lineamientos técnico-operativos para la prevención y control de la tuberculosis. En tal sentido, a fin de operativizar las nuevas alternativas terapéuticas se requiere intensificar la vigilancia por laboratorio de la sensibilidad a la rifampicina e isoniazida, a través de pruebas moleculares, financiadas con la UPC. Así mismo, las Entidades Administradoras de Planes de Beneficios de Salud, aseguramiento en salud y los administradores de los regímenes Especial y de Excepción tienen a cargo los medicamentos contemplados en el anexo 1, de la precitada resolución, que incluye medicamentos para implementar las alternativas de tratamiento para TB sensible y resistente.
Que, desde el año 2020, con la expedición de la Resolución número 227 de 2020, se implementaron los algoritmos de diagnóstico que integran la realización de técnicas de identificación para Mycobacterium tuberculosis por reacción en cadena de la polimerasa (PCR) y pruebas de Sensibilidad a Fármacos (PSF) por PCR a todo caso diagnosticado en el territorio nacional; aspectos, que están incorporados en la Resolución número 2366 de 2023.
Que, el Instituto Nacional de Salud, estableció los lineamientos para la implementación de los algoritmos de diagnóstico que adopto la Resolución número 227 de 2020, en los cuales, reitera la adopción de los mismos e indica, que, si bien, en el algoritmo para población general se continúa realizando de forma transitoria la baciloscopia, en caso de ser positiva debe hacerse una prueba molecular para evaluación de resistencia a fármacos (isoniazida y rifampicina), acompañada del cultivo en medio líquido, y en caso de presentar resistencia a cualquiera de estos dos fármacos se deberá evaluar resistencia a fluoroquinolonas y aminoglucósidos con un método molecular. Los resultados de los casos que presenten resistencia deben remitirse semanalmente a los Laboratorios Departamentales o Distritales de Salud Pública (LSPD) y al Laboratorio Nacional de Referencia (LNR) de Mycobacterias del Instituto Nacional de Salud (INS).
Que, en referencia a la prevalencia de la resistencia a isoniazida (H), la Organización Mundial de la Salud (OMS), en el reporte global de tuberculosis de 2018, indica cifras globales de resistencia a la isoniazida (cepas de M. tuberculosis con resistencia a la H y susceptibilidad a la rifampicina confirmada in vitro). La prevalencia de esta resistencia fue de 7,1% (IC 95%= 6,2-8,0%) en los casos nuevos de TB, del 7,9% (IC 95%= 5,9-10%) en los casos de TB previamente tratados y de 5,7 en los casos nuevos de la región de las Américas (2).
Que, en Colombia se realizó el estudio de vigilancia a la resistencia de M. tuberculosis a los fármacos antituberculosis entre los años 2004 y 2005, que mostró una prevalencia de 2,3% (IC 95%= 1,49-3,45) para isoniazida resistente en casos nuevos y 1,9% (IC 95%: 0,81-4,36) para casos previamente tratados, se estima que las cifras actuales son superiores al 9% en casos nuevos (3).
Que, en los términos del artículo 2o de la Resolución número 486 de 2024, los departamentos y distritos del país a los que se les transfirió recursos del Presupuesto de Gastos de Funcionamiento del Ministerio de Salud y Protección Social para cofinanciar los Programas de Prevención y Control de la Tuberculosis, para la vigencia fiscal año 2024 deben dar estricto cumplimiento a los Lineamientos Técnicos “Para la ejecución de transferencias nacionales de programas de prevención y control de tuberculosis 2024”, dentro de los cuales se establece que se financia con un máximo del 10% de los recursos asignados, el transporte de medicamentos del Programa de Control de la tuberculosis entre departamentos o municipios, según sea requerido por el nivel nacional.
Que, de acuerdo con la comunicación de la Organización Panamericana de la Salud del 15 de noviembre de 2024, la recepción del medicamento tetraconjugado más probable es la última semana de enero de 2025.
Que, teniendo en cuenta las consideraciones anteriormente expuestas se hace necesario modificar de manera parcial y transitoria, las directrices de tratamiento descritas en el Capítulo 4., de la Resolución número 227 de 2020, hasta disponer de los medicamentos antituberculosos en las cantidades suficientes en el país, como quedara en la parte resolutiva del presente acto administrativa.
En mérito de lo expuesto,
RESUELVE
ARTÍCULO 1o. MODIFICACIÓN PARCIAL Y TRANSITORIA DE LOS ESQUEMAS TERAPÉUTICOS USANDO DOSIS FIJA COMBINADA ESTABLECIDOS EN LA RESOLUCIÓN NÚMERO 227 DE 2020. Modifíquese la Tabla número 28. “Esquema de tratamiento de la tuberculosis activa en adultos y niños o niñas con peso mayor a 25 kg, usando la dosis fija combinada de RHZE 150/75/400/275MG y RH 150/75MG”, incluida en el Literal B. “esquemas terapéuticos usando dosis fija combinada” del Anexo 4. “Esquemas terapéuticos recomendados para la enfermedad tuberculosa activa y la infección tuberculosa latente” establecido en el Capítulo 4. “Directrices y recomendaciones para el tratamiento de la enfermedad tuberculosa activa” incluidos en la Resolución número 227 de 2020, el cual quedará así:
Alternativa terapéutica 1. Reducción en el número de dosis de tetraconjugado RHZE fase de intensiva establecida en la tabla 28.
Reducir a 48 dosis de lunes a sábado la fase intensiva de tratamiento de la tuberculosis sensible.
El paso a fase de continuación seguirá con las directrices de controles bacteriológicos y clínicos actualmente descritos en la Resolución número 227 de 2020. Esta reducción aplica para todos los casos niños o adultos y a todas las entidades territoriales con disponibilidad de RHZE.
Alternativa terapéutica 2. Integrar dosis fija combinada de Biconjugado R150 - H 75 y dosis individuales de Etambutol 400 mg y Pirazinamida 400 mg (peso mayor de 25 Kg): aplica para todos los casos niños o adultos de acuerdo a la disponibilidad de Etambutol y Pirazinamida en dosis individuales, cómo se describe en la siguiente tabla de acuerdo con rangos de peso:
| Peso (Kg) | Número de tabletas 48 dosis de lunes a sábado | ||
| Biconjugado Rifampicina/Isoniazida (RH 150/75 mg) | Etambutol (E 400 mg) | Pirazinamida (Z 400 mg) | |
| 25-39 | 2 | 2 | 2 |
| 40-54 | 3 | 2 | 3 |
| 55 kg o más | 4 | 3 | 4 |
Fuente: Acta comité asesor nacional de tuberculosis, sesión extraordinaria 11 de octubre de 2024.
Alternativa terapéutica 3.
Para esta alternativa se tiene en cuenta las bases bacteriológicas y terapéuticas para el tratamiento de la tuberculosis, que en escenarios ideales donde no existen casos resistentes, se considera que RHZ es la mejora asociación documentada y experimentada a nivel mundial. Por lo tanto, todo caso de tuberculosis inicial en el que se presuma la sensibilidad a todas las drogas, este, sería el tratamiento indicado.
Sin embargo, el amplio uso que se ha hecho a la isoniazida – H, ha condicionado que frecuentemente un número variable de casos nuevos, presenten resistencia inicial a esta droga. Es por ello, que los esquemas de tratamiento para tuberculosis integran un cuarto fármaco, que de elección es el etambutol, a fin de proteger la rifampicina – R en los casos con resistencia inicial a H, no conocida.
Por lo anterior, prueba inicial que demuestre la sensibilidad a H y R, el esquema propuesto con tres medicamentos (RHZ) puede usarse de forma segura y eficaz.
Dada, la necesidad de conocer la sensibilidad a isoniazida y rifampicina, se plantean dos escenarios para esta alternativa:
Alternativa terapéutica 3. Escenario 1. Paciente confirmado que cuenta con resultado de pruebas de sensibilidad con resultado sensible a rifampicina e isoniazida:
| Peso (Kg) | Número de tabletas 48 dosis de lunes a sábado | |
| Biconjugado Rifampicina/ Isoniazida (RH 150/75 mg) | Pirazinamida (Z 400 mg) | |
| 25-39 | 2 | 2 |
| 40-54 | 3 | 3 |
| 55 kg o más | 4 | 4 |
Fuente: Acta comité asesor nacional de tuberculosis, sesión extraordinaria 1 de noviembre de 2024.
Alternativa terapéutica 3. Escenario 2. Paciente confirmado que cuenta con resultado de pruebas de sensibilidad a rifampicina/ isoniazida desconocida y/o sin pruebas de sensibilidad.
Esta alternativa integra la adición de una quinolona que puede ser levofloxacina o Moxifloxacina (que incluye todas las concentraciones y formas farmacéuticas con registro sanitario vigente). Debe preferirse siempre el uso de levofloxacina al de moxifloxacina, dado que será un medicamento esencial con la incorporación de esquemas BPALM.
La definición de la quinolona se realizará según la disponibilidad de los proveedores de medicamentos de los responsables del aseguramiento, por lo cual es importante que se comunique a la red prestadora y a la entidad territorial la disponibilidad para la formulación. Así mismo, las EABP, deberán gestionar la entrega centralizada de este medicamento a la red prestadora para evitar la autoadministraci ón sin supervisión.
En la siguiente tabla se presenta la dosificación por peso para esquemas de la alternativa 3. Escenario 2.
Esquema con disponibilidad de Levofloxacina:
| Peso (Kg) | Número de tabletas 48 dosis de lunes a sábado | ||
| Biconjugado Rifampicina/Isoniazida (RH 150/75 mg) | Pirazinamida (Z 400 mg) | Levofloxacina* | |
| 25-39 | 2 | 2 | 500 mg/día |
| 40-54 | 3 | 3 | 750 mg/día |
| 55 kg o más | 4 | 4 | 1000 mg/día |
Fuente: Acta comité asesor nacional de tuberculosis, sesión extraordinaria 1 de noviembre de 2024.
Esquema con disponibilidad de Moxifloxacina:
| Peso (Kg) | Número de tabletas 48 dosis de lunes a sábado | ||
| Biconjugado Rifampicina/Isoniazida (RH 150/75 mg) | Pirazinamida (Z 400 mg) | Moxifloxacina* | |
| 25-39 | 2 | 2 | 400 mg/día |
| 40-54 | 3 | 3 | 400 mg/día |
| 55 kg o más | 4 | 4 | 400 mg/día |
Fuente: Acta comité asesor nacional de tuberculosis, sesión extraordinaria 1 de noviembre de 2024.
*Si se inició la quinolona por desconocer la sensibilidad a la isoniazida, una vez se demuestre la sensibilidad, se deberá retirar.
PARÁGRAFO. Una vez se cuente con disponibilidad de etambutol, este medicamento se integrará al esquema de tratamiento en la dosificación definida en la Resolución número 227 de 2020 y se retirará la quinolona.
En todos los casos, las dosis se suministrarán en una sola toma que puede tener espacio entre tabletas para permitir la tolerancia, sin que el tiempo entre tabletas afecte los picos de concentración requeridos.
Se deberá iniciar y terminar con el mismo esquema; es importante para no afectar la adherencia al tratamiento.
ARTÍCULO 2o. VIGILANCIA ESTRICTA DE LA RESISTENCIA A RIFAMPICINA E ISONIAZIDA. Para la implementación de las medidas terapéuticas alternativas se deberá garantizar la realización de pruebas moleculares rápidas que permitan determinar la sensibilidad a Rifampicina e Isoniazida. Así mismo, cuando las técnicas de PCR generan un resultado sensible o resistente, no se requiere que este sea confirmado a través de un método convencional. Las entidades territoriales exigirán el cumplimiento de esta directriz de forma estricta a la red de Instituciones Prestadoras de Servici os de Salud.
Las Entidades Administradoras de Planes de Beneficios de Salud presentarán y fortalecerán las rutas para el acceso a estas pruebas, garantizando la calidad técnica y oportunidad en los resultados en máximo 48 horas desde la toma de la muestra, teniendo en cuenta que para el acceso a estas pruebas de diagnóstico no se requiere ningún tipo de autorización, tal como se describe en la Resolución número 227 de 2020 y en los lineamientos de implementación de algoritmos de diagnóstico publicados por el INS.
ARTÍCULO 3o. ALTERNATIVAS EN TUBERCULOSIS FARMACORRESISTENTE. Se deberán evaluar los casos de TB MDR/RR a fin de identificar personas elegibles para tratamiento acortado entre un máximo de 9 a 11 meses, considerando como éxito terapéutico los criterios de seguimiento bacteriológico y microbiológico (negativización temprana con Bk negativo al segundo mes y al menos los últimos tres cultivos negativos), la mejoría clínica y radiológica. Recomendación aprobada Comité Asesor Nacional de Tuberculosis.
De igual forma, se deberán implementar los ESQUEMAS CORTOS DISPONIBLES EN EL PAÍS (Anexo). La base científica de esta medida está soportada en la disponibilidad de fármacos como la bedaquilina, clofazimine y el linezolid, que sumados a las quinolonas suministran el suficiente efecto bactericida y esterilizante, permitiendo en primera instancia continuar con esquemas totalmente orales y en segunda acortar tratamientos. Estos medicamentos de uso específico para tuberculosis están incluidos en el Anexo 4. Medicamentos para Programas Especiales en Salud Pública, el linezolid y las quinolonas como levofloxacina y moxifloxacina incluidas en el anexo 1 “Listado de medicamentos financiados con recursos de la Unidad de Pago por Capitación (UPC)”.
ARTÍCULO 4o. RESPONSABILIDADES DE LOS ACTORES DEL SISTEMA. Las autoridades departamentales, distritales y municipales, en coordinación con las Entidades Administradoras de Planes de Beneficios de Salud, los administradores de los regímenes Especial y de Excepción y responsables de aseguramiento de la población pobre no afiliada, así como las Instituciones Prestadoras de Servicios de Salud (IPS), aplicarán las alternativas terapéuticas dispuestas en la presen te resolución.
Las Entidades Administradoras de Planes de Beneficios de Salud, en marco de lo establecido en el anexo 1 (Listado de medicamentos financiados con recursos de la UPC) de la Resolución número 2366 de 2023, garantizarán la entrega de la levofloxacina, moxifloxacina y el linezolid, para las alternativas terapéuticas de TB sensible y tratamiento estandarizado de la TB farmacorresistente.
Listado de medicamentos incluidos en el Anexo1, de la Resolución número 2366 de 2023.
| No. | PRINCIPIO ACTIVO | FINANCIACIÓN CON RECURSOS DE LA UPC | ACLARACIÓN |
| 648 | LEVOFLOXACINA | INCLUYE TODAS LAS CONCENTRACIONES Y FORMAS FARMACÉUTICAS | |
| 665 | LINEZOLID | INCLUYE TODAS LAS CONCENTRACIONES Y FORMAS FARMACÉUTICAS | |
| 761 | MOXIFLOXACINA | INCLUYE TODAS LAS CONCENTRACIONES Y FORMAS FARMACÉUTICAS | |
Así mismo, las Entidades Administradoras de Planes de Beneficios de Salud articularán con la entidad territorial departamental, distrital y su red prestadora, la entrega centralizada que garantice el suministro oportuno y directamente observado de los medicamentos bajo la modalidad que se concerte con la persona a fectada.
Las autoridades departamentales, distritales y municipales, en coordinación con las Entidades Administradoras de Planes de Beneficios de Salud, los administradores de los regímenes Especial y de Excepción y responsables de aseguramiento de la población pobre no afiliada, así como las Instituciones Prestadoras de Servicios de Salud (IPS), deben brindar información adecuada, transparente y veraz, basada en la evidencia científica, sobre la alternativa terapéutica para fortalecer la adherencia, y cumplimiento del tratamiento por parte del paciente.
Las Entidades Administradoras de Planes de Beneficios de Salud, los administradores de los regímenes Especial y de Excepción y responsables de aseguramiento de la población pobre no afiliada, así como las Instituciones Prestadoras de Servicios de Salud (IPS), deberán reforzar acciones de seguimiento estricto y acompañamiento psicosocial a las personas afectadas, favoreciendo la adherencia al tratamiento y elaborarán un plan, concertado con la entidad territorial, para garantizar la realización de pruebas moleculares descritas y las acciones de seguimiento y la modalidad de tratamiento directamente observad o (TDO).
ARTÍCULO 5o. TRASLADO DE LOS MEDICAMENTOS ANTITUBERCULOSIS DE COMPRA CENTRALIZADA. las entidades territoriales en el nivel departamental y distrital adoptarán e implementaran los mecanismos administrativos necesarios para cubrir los costos de la redistribución de los medicamentos según necesidad; así como, el reempaque para distribución individual de medicamentos disponibles en frascos multidosis, aspecto que podrá ser financiado a través de los recursos de transferencias nacionales 2024.
ARTÍCULO 6o. VIGENCIA. La presente resolución rige a partir de la fecha de su publicación, hasta tanto se garantice el abastecimiento de medicamentos en el país sin que supere el 31 de diciembre del año 2024.
Publíquese y cúmplase.
Dada en Bogotá, D. C., a 2 de diciembre de 2024.
El Ministro de Salud y Protección Social,
Guillermo Alfonso Jaramillo Martínez.
Anexo. Adopción de Esquema cortos 100% orales para TB MDR/RR
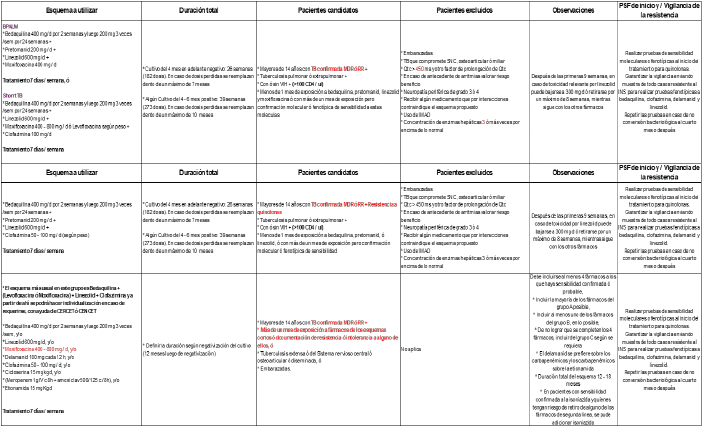
Enfermedad extensa: enfermedad cavitaria bilateral o compromiso extenso.
Cuando se use esquemas alargados y se prevea que podría requerirse el retiro de algún fármaco por razones de toxicidad o interacciones, es mejor iniciar con 5 y no 4 medicamentos.



